- 기자
[PEDIEN] 식품의약품안전처(식약처)가 신기술 기반의 혁신 의료제품 개발을 지원하기 위해 최신 상담 사례를 담은 안내서를 개정, 배포했다. 이는 제약 및 의료기기 업계가 연구개발 과정에서 겪는 시행착오를 최소화하고 제품 출시 속도를 높이는 데 실질적인 도움을 주기 위함이다.
식품의약품안전평가원은 10월 14일 ‘의료제품 개발 상담사례집’ 개정판을 공개한다고 밝혔다. 이번 사례집에는 지난 1년간(2024년 8월부터 2025년 7월까지) 진행된 ‘혁신제품 사전상담’ 내용이 집약됐다.
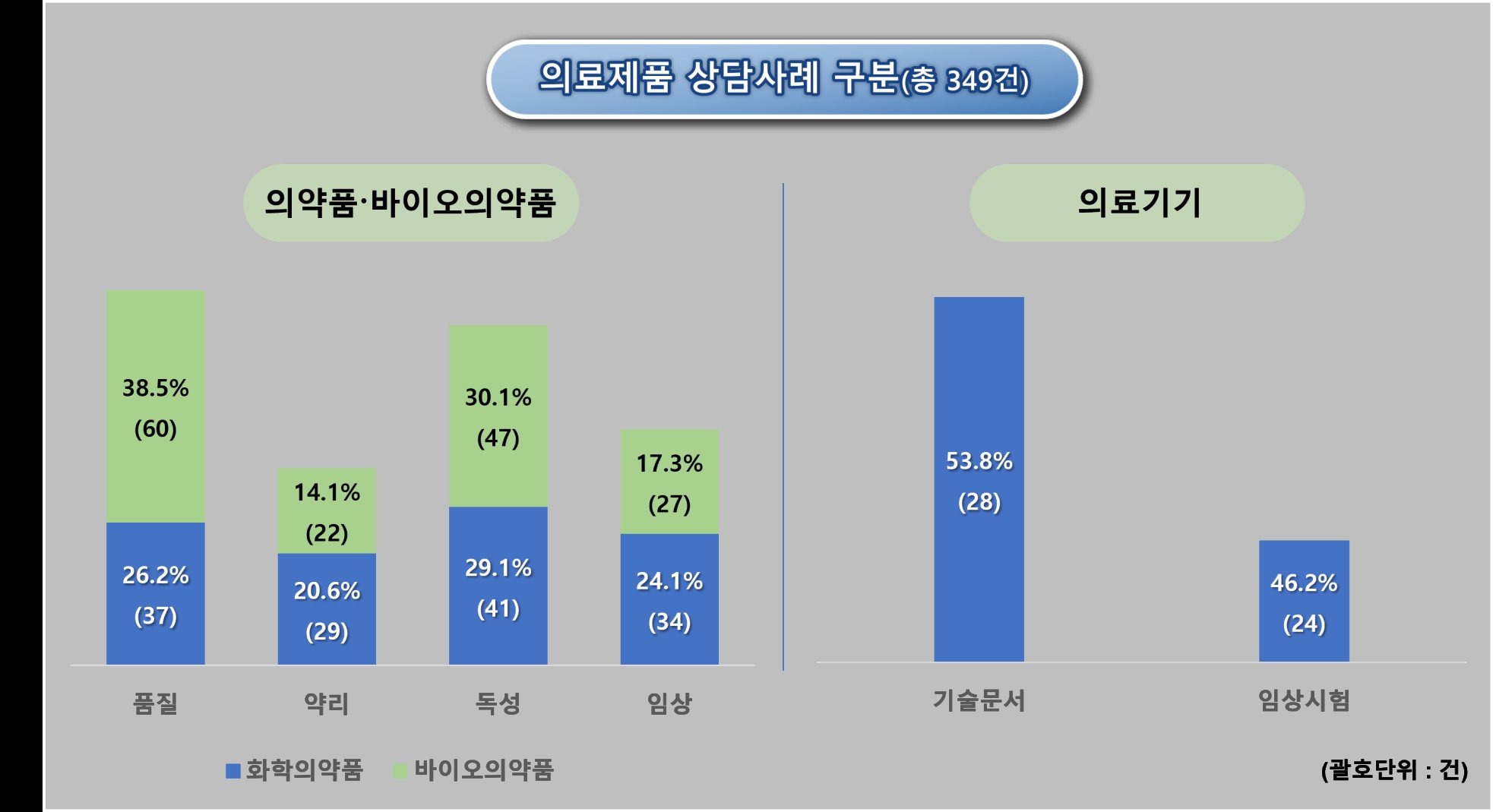
총 349건의 의약품 및 바이오의약품 상담 사례와 52건의 의료기기 관련 상담 사례가 포함됐다. 특히 의약품 분야에서는 141건, 바이오의약품 분야에서는 156건의 최신 개발 동향이 반영됐다.
사례집은 최근 주목받는 신기술·신개념 의료제품에 대한 구체적인 규제 가이드라인을 제시한다. 의약품 및 바이오 분야에서는 표적단백질분해제, 방사성의약품, mRNA 백신, 항체-약물 복합체(ADC) 등 첨단 기술 개발 시 품질, 비임상, 임상 단계에서 고려해야 할 핵심 사항들을 상세히 안내했다.
의료기기 분야에서는 전동식 의료용 흡인기의 성능 평가 항목 설정 같은 기술 문서 작성 사례를 다뤘다. 또한, 언어음성장애 진단 보조 소프트웨어와 같이 인공지능(AI) 모델 구축에 사용된 데이터의 임상시험 활용 가능 여부 등 새로운 형태의 임상시험 상담 내용도 포함됐다.
식약처는 사례집과 함께 혁신 의료제품 개발을 희망하는 연구자 및 기업이 규제 지원을 받을 수 있는 ‘혁신제품 사전상담’의 신청 대상, 방법, 절차 등도 상세히 안내했다.
식약처는 이번 사례집 개정이 업계의 규제 관련 애로사항을 해소하는 데 큰 도움이 될 것으로 기대하고 있다. 앞으로도 연구개발 단계부터 최종 허가까지 단계별 맞춤 상담을 지속적으로 제공하며 신속한 제품화를 적극적으로 지원할 방침이다.
저작권자 © PEDIEN 무단전재 및 재배포 금지